悪性黒色腫の進展を支える遺伝子発現メカニズムを解明~がんの治療法開発に期待~
熱ストレスなどによるタンパク質の構造異常に対して、細胞は一群の熱ショックタンパク質(HSP)の転写を誘導することで適応します。この転写誘導はクロマチン構造変化を伴っており、活性化された転写因子HSF1によって制御されます。興味深いことに、活性化HSF1はヒトのがんの発症と進展を支えることも知られています。山口大学大学院医学系研究科の藤本充章准教授、中井彰教授らの研究グループは、熱ストレス時に活性化されたHSF1がクロマチン構造変化を引き起こす仕組みを明らかにしました。さらに通常状態のがん細胞では、このHSF1リン酸化を介する仕組みが作動することでその増殖を促進することが分かりました。特に、悪性黒色腫細胞のマウスでの腫瘍形成は、このHSF1リン酸化に強く依存していることを見出しました。本研究結果は、細胞のストレス応答におけるクロマチン制御機構の解明につながる成果であると同時に、リン酸化をターゲットとする悪性黒色腫の新規治療法を提案しています。
本成果は、2022年7月29日に、英国の国際学術誌「Nature Communications」にオンライン掲載されました(DOI:10.1038/s41467-022-32034-4)。
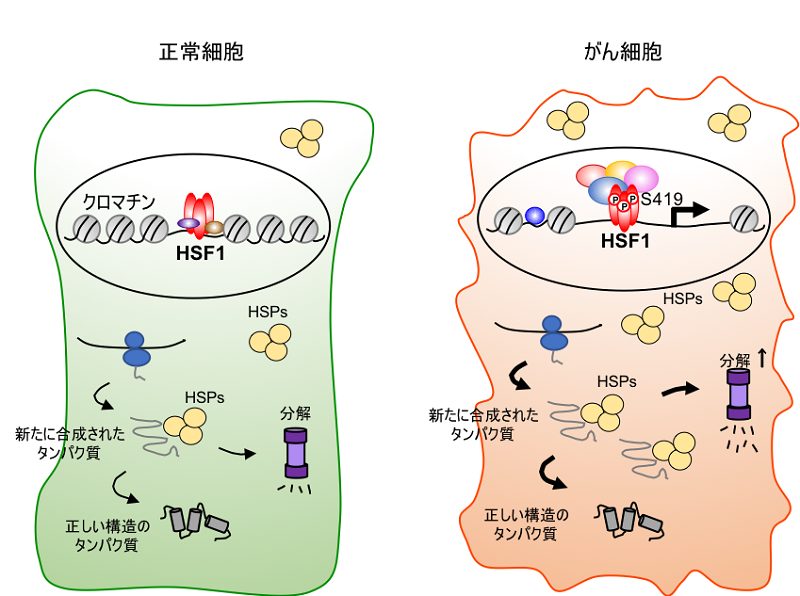
概要図 がん細胞におけるHSF1とタンパク質恒常性
正常細胞では新しく合成されたタンパク質は、HSP群によるタンパク質フォールディングと分解のバランスによって正しい構造に保たれる(左)。この時、HSF1の一部はクロマチンに結合してHSP群の構成的発現を調節している。がん細胞ではHSF1-S419リン酸化によってHSP遺伝子のクロマチン構造の弛緩と転写亢進が引き起こされる。がん細胞内は凝集体を形成しやすい状態にもかかわらず、HSP群が増加することでタンパク質は正しい構造に保たれる(右)。
発表論文の情報
- タイトル: HSF1 phosphorylation establishes an active chromatin state via the TRRAP-TIP60 complex and promotes tumorigenesis(HSF1リン酸化はTRRAP-TIP60複合体を介して活性クロマチン状態を確立して腫瘍形成を促進する)
- 著者:Fujimoto M, Takii R, Matsumoto M, Okada M, Nakayama KI, Nakato R, Fujiki K, Shirahige K, and Nakai A.
- 掲載誌:Nature Communications
- DOI:https://doi.org/10.1038/s41467-022-32034-4
研究プロジェクトについて
本研究は新潟大学、九州大学、東京大学と共同で行われたものです。また、本研究プロジェクトは、日本学術振興会・基盤研究B「クロマチン制御による熱ショック応答の調節機構の解明」、日本学術振興会・基盤研究C「HSF1複合体によるエピジェネティックな遺伝子発現制御機構の解明」、上原記念生命科学財団助成「HSF1複合体によるエピジェネティックな遺伝子発現制御」、武田科学振興財団助成「染色体分配関連因子による転写開始前複合体形成の制御」、九州大学生体防御医学研究所・共同研究課題「生細胞内で形成されるHSF1転写複合体の解析」及び「エピジェネティック制御を担うHSF1転写複合体の解明」、創薬等先端技術支援基盤プラットフォーム(BINDS)・支援課題「ヒストンアセチル化を介した熱ショック応答の分子機構解明」のご支援によって遂行されました。

