立体的効果を使うことで有機ホウ素の新しい反応性を引き出すことに成功:次世代型精密有機合成への応用へ期待
発表のポイント
- 立体的に保護された新規有機ホウ素反応剤を開発
- ホウ素反応剤の反応性を容易にON/OFF可能
- 分子骨格の戦略的な構築が可能
概要
様々な種類がある有機ホウ素反応剤は、多くの有機合成に使われています。特に、鈴木-宮浦カップリング(SMC:2010年ノーベル化学賞)が芳香族や複素環などパイ共役系機能分子の合成に大きな変革をもたらしたため、有機ホウ素は人類の生活に欠くことのできない反応剤です。従って、これをさらに高機能化できるかどうかが、今後の機能物質合成化学の飛躍的発展を左右します。そのため、有機ホウ素の反応性をより精密にコントロールするために、新たな設計指針創出が次世代型分子合成分野にとって喫緊の課題となっています。
これまでに、有機ホウ素の反応性をコントロールするために、ホウ素原子を電子的に保護できる手法が開発され、その反応性を自在に操れるようになりました。しかし、電子的な保護法を用いると、ホウ素自身の反応性が犠牲になり、その活性度の調整が難しいという問題がありました。そのため、この電子的な保護に代わる新しい方法論の開発が求められているのが現状です。
山口大学大学院創成科学研究科応用化学分野の西形孝司教授(若手先進)らは、ホウ素を立体的に保護することで、高反応性を維持しつつ、その反応性を精密に制御できることを見出しました。これにより、芳香族や脂肪族分子を合成する際に、新しい反応化学的手法を適用できるようになります。
本研究で開発された立体障害型ホウ素反応剤は、水の存在/非存在下でその反応性をON/OFFすることができるため、反応性を自在にコントロールすることができます。ホウ素原子をオキサザボロリジノン構造という非常にかさ高い分子骨格で覆うことができた点が今回の研究のポイントです。
この研究成果は『Chemistry –A European Journal』雑誌に採択され、さらに、優れた研究成果のみが選ばれるVery Important Paper(VIP:TOP5%論文)に選出されました。今後、新規ホウ素反応剤を用いた電子材料や医薬品合成分野への応用が期待されます。
背景
2010年のノーベル化学賞は、パラジウム触媒による有機ホウ素と有機ハロゲン化物との鈴木-宮浦クロスカップリング反応が対象分野でした。この手法は、ベンゼン環などの芳香族化合物を効率的につなぐことで、医農薬品や電子材料など幅広い有用物質を合成できる点で非常に優れています。有用物質合成分野では、すべてのプロセスでクロスカップリング反応を用いているといっても過言ではありません。しかし、便利な反応であり基礎研究も40年にわたる厚みがあるにも関わらず、未解決の問題もあります。それが本研究対象である有機ホウ素反応剤の反応性制御に関してです。
研究内容
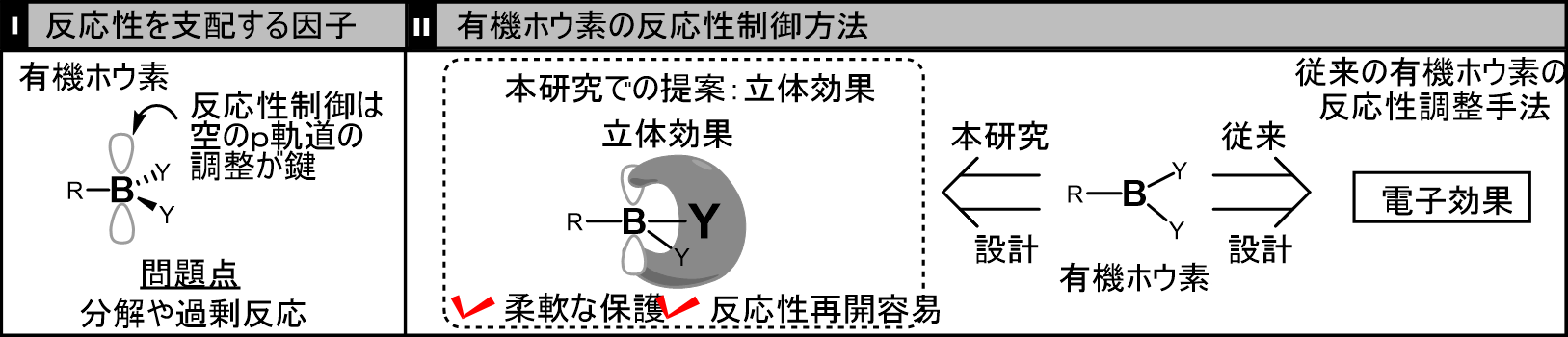
有機ホウ素反応剤の反応性を握っている要因の一つは、そのホウ素原子の空のp軌道の存在です。これは電子を引き寄せる効果があり、まわりの反応剤を引き寄せることで優れた反応性を発揮します。しかし、この影響は良い影響ばかりではなく、悪い効果もあります。それは、予期せぬ分解や過剰反応といった反応性制御に関する問題です(下図I:反応性を支配する因子)。そこで、今から20年近く前に、ホウ素反応剤を、電子的な効果でp軌道を覆うことでその反応性をうまく制御する試みが行われ成功していました。この成果は非常に大きく、現在でも様々な場面で役に立っています。しかしながら、電子的な手法では、有機ホウ素の反応性を握るp軌道を電子的に覆ってしまうと、反応性をOFFにするには都合が良くても、p軌道を再び開く、すなわち、反応性をONにすることが困難であるという問題の解決が長年の課題でした。これを解決する手法の研究も試みられていますが、p軌道を“覆う”(反応性OFF)と、“開く”(反応性ON)という2つの相反する反応性制御法を開発しなければならず、難航しています(下図II:右側 電子効果)。
一方、本研究のアイデアは、ホウ素周りに立体効果を付与することです(下図II:左側 立体効果)。ホウ素の反応性を握っているp軌道は立体的に覆われているだけなので、その根本的な反応性は損なわれていません。我々はこのような概念を実現するような新しい有機ホウ素反応剤である“立体障害型有機ホウ素”の設計・開発に取り組みました。
これまでに我々は、アルキル基(脂肪鎖)を中心とした立体障害に関する有機合成研究を実施しており、その研究過程で開発したアルキル立体障害分子をホウ素の保護基として利用したところ、オキサザボロリジノンという新しい有機ホウ素反応剤の合成に成功しました(下図III:赤丸部分が立体効果による保護効果発現部位)。これを用いると、保護基のアルキル基は常に動いているため、ホウ素原子を“覆う”と、“開く”という2つの相反する状態を一度に創り出すことができます。すなわち、反応性のON/OFF状態が常に混在した状態になっており、いつでも保護しながらいつでも反応性再開の準備ができています(下図IV)。当初、このON/OFFのどちらが強く働いてしまうのかという懸念がありましたが、どちらかというと常にOFFの状態であり、反応性をONの状態に保つには、少量の水の添加が必要だということを見出しました。原理的な詳細は割愛しますが、水のような小さな分子が、ホウ素上に一時的に解放された小さな空間に取り込まれると、ホウ素が活性化され、反応に用いることができます。
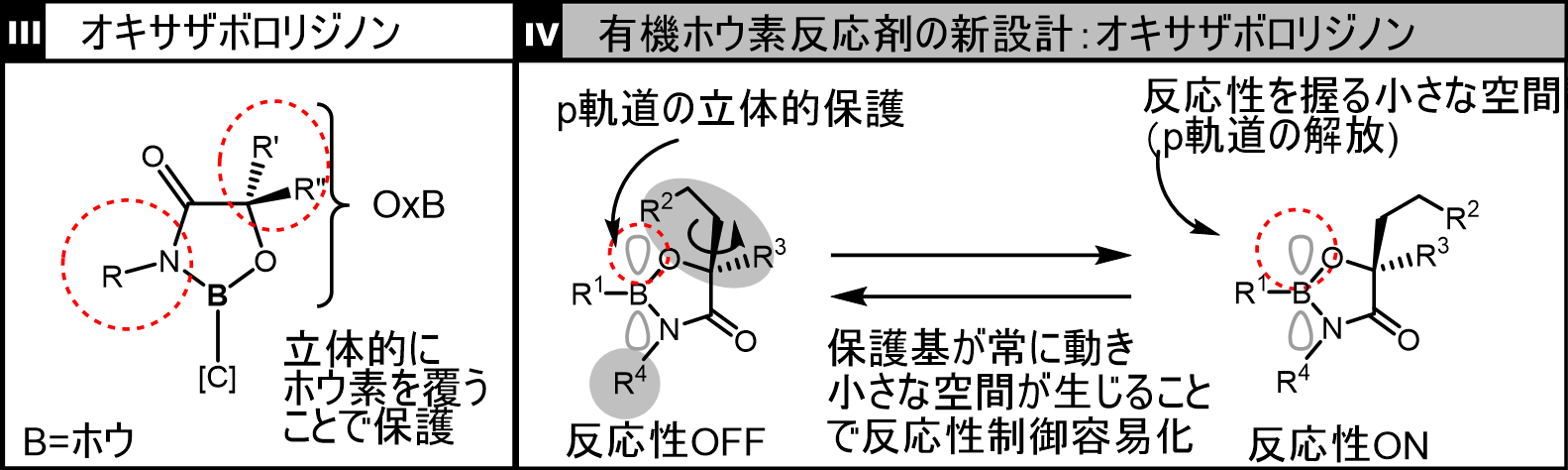
図:開発したオキサザボロリジノンとその新設計概念
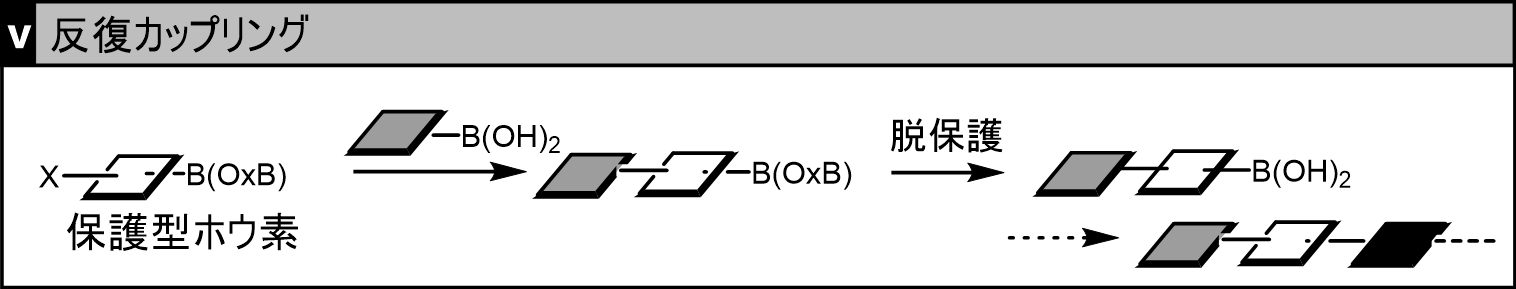
この保護現象を応用すると、以下のような反復型カップリング反応(同じ反応を繰り返すことで分子を整列させること)を行うことが可能です(下図V)。これにより精密に分子を整列させることができるため、精密な機能を持つ分子合成が実施することができます。
今後の展開
有機ホウ素反応剤の適正な保護基を設計することは、複雑な有用分子を合成するために必須のテクノロジーです。従来のホウ素の電子的な保護に加え、今回の我々の研究により、立体効果による保護も有用であることを証明することができました。今後はこれらを複合的に応用することでさらに有用な保護手法の開発が可能になります。
なお、本研究は、JST次世代研究者挑戦的研究プログラム、JST戦略的創造研究推進事業「CREST」、JST ASTEP[トライアウト]、学術振興会科学研究費補助金基盤研究Bの助成を受けて実施したものです。
論文情報
- タイトル:Oxazaborolidinones: Steric Coverage Effect of Lewis Acidic Boron Center in Suzuki-Miyaura Couplings
- 著者名:Naoki Tsuchiya, Takaki Nojiri, Takashi Nishikata
- 掲載誌:Chemistry –A European Journal(VIPに選出)
- 掲載日時:令和5年12月27日(水)19時00分(東部標準時)
- D O I:10.1002/chem.202303271

